細胞存続性を研究する形態学的表面解析

Dr. Michele Ferrari, Dr. Francesca Cirisano, and Dr. M. Carmen Morán
この作業は、薬学および食品科学部(UB)と凝縮物質化学およびエネルギー技術研究所(ICMATE-CNR)間の協力協定(Codi GREC 18407)の枠組みで構想されました。本論文は、ミケーレ・フェラーリ博士とフランチェスカ・チリサーノ博士(イタリア、ジェノヴァのICMATE-CNR)と、マリア・カルメン・モラン博士(スペイン、バルセロナのUB薬学および食品科学部)によって行われた研究の一部です。
細胞形態の変化を特定するためのプロフィロメトリの使用は、潜在的な薬剤や有害物質のスクリーニングにおいて、細胞死の二つの主要なモデルを区別するための興味深いツールと考えられます。
アポトーシスおよび壊死の過程では、治療の初期段階で劇的な細胞体積変化が起こります。これらのプロセスを区別することは、生物物理学的および治療上の観点から重要です。アポトーシスは細胞のプログラムされた死滅過程であり、壊死は環境の乱れによる偶発的な細胞死です。治療が壊死ではなくアポトーシスを誘発する場合、より良い結果が期待されます。さらに、細胞増殖プロセスは細胞体積の変化を引き起こし、細胞成長の指標となります。
本研究では、生理学的な細胞と病理学的な細胞を明確に区別するために、非侵襲的な形態学的表面解析技術と確立された生化学的手法を組み合わせて示します。要約すると、プロフィロメトリ解析により、適切なナノ粒子(NPs)によって誘発される細胞体積の変動が、伝統的な方法で測定される細胞生存応答と互換性がある増殖および細胞死の前駆体として明らかにされます。
このプロジェクトは本質的に学際的であり、異なる素材の特性と生物学的対象との相互作用を必要とします。それはチームメンバーの異なるバックグラウンドからもわかる通りです。フェラーリ博士率いるグループは、液体-固体界面での親水性分子の吸着と凝集、高い撥水性コーティングの調製、およびAFMおよび3Dプロフィロメトリ技術を用いた特性評価に取り組んでいます。モラン博士率いるグループは、制御されたデリバリーシステムの開発と、2D(バルクおよび基板)および3D条件下でのそのin vitro特性評価に焦点を当てています。
S neox 3Dプロフィロメータは、大きな表面を分析し、スキャンから重要な表面パラメータを取得する能力を持つため、使用されました。プロフィロメトリによる表面特性の解析は、ISO 25178規格に基づいて行われました。この規格は、表面テクスチャの三次元パラメトリック評価のための基準を提供しています。
対象条件下の細胞を含むカバーガラスの全表面は、共焦点モードを使用して分析されました。選択した領域の細胞について、高さ(H)と長さ(L)の対応するプロファイルをSensoSCAN S neoxソフトウェアで分析しました。対応する形状係数(SP)は、H/L値の関数として決定されました。
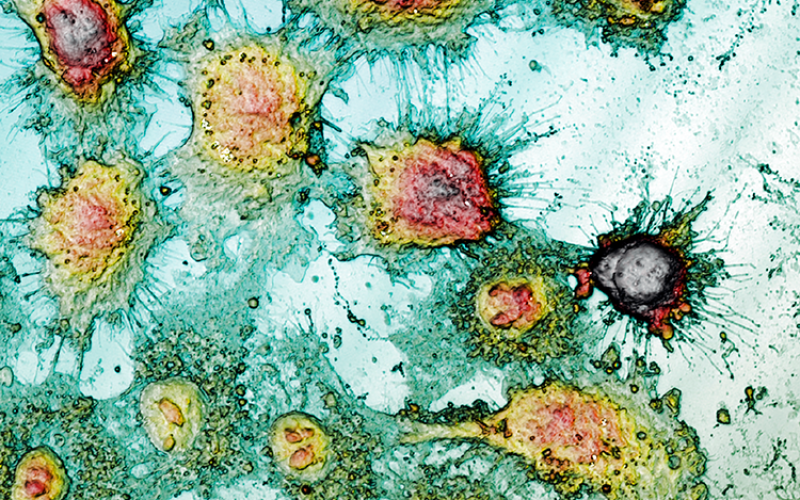
光学的スキャニングプロフィロメトリの利点は、侵襲的で非破壊的な特性評価が可能であり、わずかなcm2に限定されない大きな表面を分析できることです。さらに、測定時間はAFM技術の経験に比べて短縮されており、高分解能の定量的・定性的な情報をナノ・マイクロスケールで提供する顕微鏡技術として優れています。この技術では、蛍光タンパク質マーカーや光学的に活性な染料は必要ありませんが、共焦点モードや干渉計モードでの3Dスキャンプロフィロメトリは、細胞の幾何学パラメータの高精度な評価が可能です(図1a)。その結果、標準条件下の3T3線維芽細胞は、伸びた形状を持つ典型的な双極性または多極性構造を示します。さらに、HaCaT、HeLa、およびA431細胞などの上皮様細胞は、より規則的な寸法を持つ多角形の形状であり、離散的なパッチで成長します。NPs処理により、3T3線維芽細胞はフィロポジアを持たずに卵形の外観を示しました。上皮細胞は細胞間の境界の大幅な欠如と形状の不規則性を経験します。
得られたプロファイルの分析(図1b)により、細胞増殖および細胞毒性の誘導のための処理にさらされた制御細胞の高さや長さなど、いくつかの構造パラメータを定量的に評価することが可能となりました。

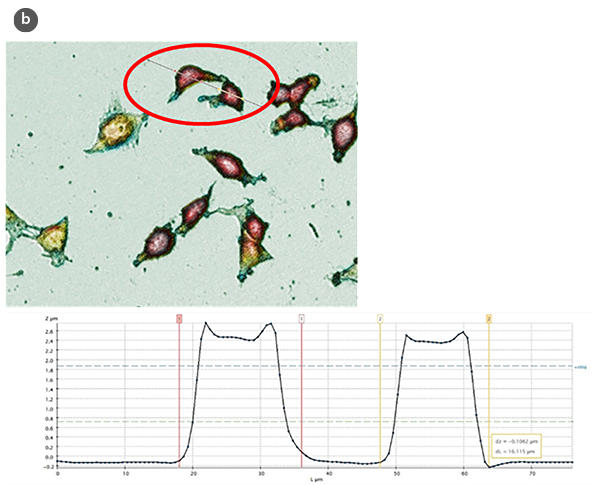
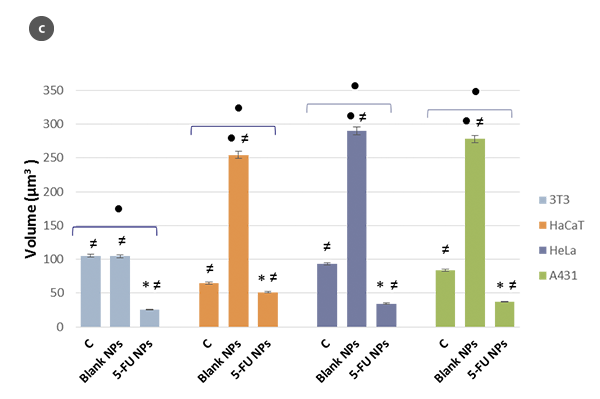
細胞の形態の変化と形状係数のH/L比の値に対する関数として、図2aと2bにまとめられています。細胞の幾何学的近似として球状のキャップモデルを使用することで、細胞の体積を推定しました(図2c)。得られた値は、SensoSCAN S neoxソフトウェアを直接使用した場合の値と一致しており(すべての場合で5%未満の差)、細胞のエッジが考慮されています。
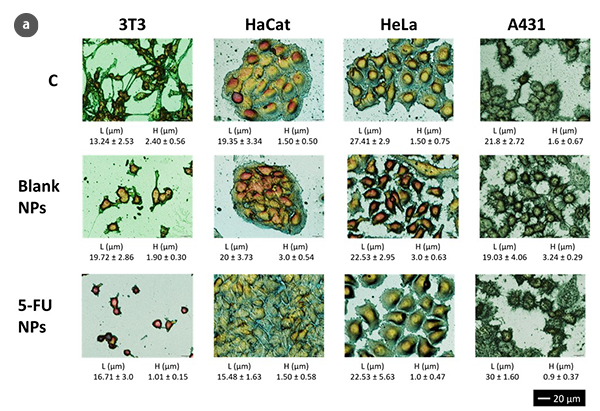
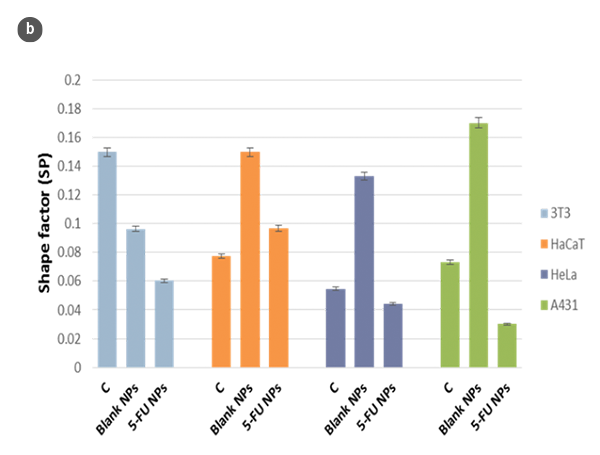
光学プロフィロメトリを使用して、MTT細胞生存性試験などの従来の方法と互換性のある反応時間で細胞形態の分析が行われました[6]。ただし、これらの分析は、生存細胞数の変化なしにMTT作用による代謝活性の変化による矛盾した結果を回避します。また、細胞生存性の測定結果は、104-105細胞/mLの代謝活性の算術平均から得られます。このような大量の細胞は、非常に早い段階や細胞集団の小さな部分での形態変化の決定を妨げる可能性があります。
3Dプロフィロメトリによる単一細胞の体積の測定は、細胞死のパターンやメカニズムを確立する上で付加価値を持ちます。それは単純な細胞生存性試験では検出できない、他の技術の限界を超えた表面でも(cm2単位で)細胞形態の変化を観察するための興味深いツールと見なすことができます。特に、治療手法の成功期待の早期予測のために、細胞死の最も重要なモデルを区別することで、潜在的な薬剤や有毒物質のスクリーニング中に細胞形態の変化を観察するための興味深いツールと見なすことができます。
生物医学研究の成功は、疾患治療におけるナノマテリアルの応用とそれらの診断ツールの開発にあります。この研究では、定性的および定量的な分析を設定する3D光学プロフィロメトリが、潜在的な治療薬や有毒薬物送達システムのスクリーニングツールの要件を満たしており、細胞の成長を促進したり、細胞の死を誘発するための研究において興味深い手法です。この研究は、治療と診断の両分野を結合した研究チームの初の論文です。
参考文献
[1] M. C. Morán, F. Cirisano, M. Ferrari. 3D profilometry and cell viability studies for drug response screening. Mat. Sci. Eng. C. 115(2020) 111142
[2] E. Guzmán, L. Liggieri, E. Santini, M.Ferrari, F. Ravera, F. Mixed DPPCcholesterol Langmuir monolayers in presence of hydrophilic silica nanoparticles. Colloids Surf B. Biointerfaces. 105 (2013) 284-293.
[3] J.L. Rinn, C. Bondre, H.B. Gladstone, P.O. Brown, H.Y. Chang. Anatomic demarcation by positional variation in fibroblast gene expression programs. PLoS Genet. 2 (2006) e119.
[4] M.C. Morán, J. Carazo, M.A. Busquets.Dual responsive gelatin-based nanoparticles for enhanced 5-fluorouracil efficiency. Colloids and Surfaces B: Biointerfaces 172 (2018) 646-654.
[5] J.A. Hessler, A. Budor, K. Putchakayala, A. Mecke, D. Rieger, M.M B. Holl, B.G.Orr,A. Bielinska, J. Beals, J.J. Baker. Atomic force microscopy study of early morphological changes during apoptosis. Langmuir 21 (2005) 9280-9286.
[6] T. Mosmann. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods 65 (1983) 55-63.











