Morphologische Oberflächenanalyse zur Untersuchung der Zelllebensfähigkeit

Dr. Michele Ferrari, Dr. Francesca Cirisano, and Dr. M. Carmen Morán
Diese Arbeit wurde im Rahmen des Kooperationsabkommens zwischen der Fakultät für Pharmazie und Lebensmittelwissenschaften (UB) - Institut für Chemie kondensierter Materie und Technologien für Energie (ICMATE-CNR) (Codi GREC 18407) konzipiert. Der vorliegende Artikel ist Teil der Forschung, die von Dr. Michele Ferrari und Dr. Francesca Cirisano (ICMATE-CNR, Genua-Italien) sowie Dr. M. Carmen Morán (Fakultät für Pharmazie und Lebensmittelwissenschaften, UB, Barcelona-Spanien) durchgeführt wurde.
Die Verwendung von Profilometrie zur Bestimmung von Veränderungen in der Zellmorphologie kann als aufregendes Werkzeug zur Untersuchung potenzieller Medikamente und toxischer Materialien betrachtet werden, um zwischen den beiden wichtigsten Modellen des Zelltods zu unterscheiden.“
Während der Prozesse der Apoptose und Nekrose treten in den frühen Stadien der Behandlung dramatische Veränderungen des Zellvolumens auf. Die Unterscheidung zwischen diesen Prozessen ist aus biophysikalischer und therapeutischer Sicht entscheidend. Die Apoptose ist ein programmiertes Verfahren des zellulären Todes, während die Nekrose ein zufälliger Tod ist, der durch Umwelteinflüsse verursacht wird. Wenn eine Behandlung Apoptose anstelle von Nekrose auslöst, ist es wahrscheinlicher, dass ein besseres Ergebnis erzielt wird. Darüber hinaus führen Zellproliferationsprozesse zu Veränderungen des Zellvolumens als Maß für das Zellwachstum.
In dieser Studie zeigen wir nicht-invasive morphologische Oberflächenanalysetechniken, die gut bewährte biochemische Methoden ergänzen, um physiologische von pathologischen Zellen klar zu unterscheiden. Kurz gesagt ermöglicht die Profilometrie-Analyse Variationen im Zellvolumen, die durch geeignete Nanopartikel (NPs) als Vorläufer von Proliferation und Zelltod induziert werden und mit den mit konventionellen Methoden gemessenen Zellviabilitätsreaktionen kompatibel sind.
Dieses Projekt ist von Natur aus interdisziplinär, da es die Charakterisierung verschiedener Materialien und deren Wechselwirkung mit den interessierenden biologischen Einheiten erfordert, wie dies anhand der unterschiedlichen Hintergründe der Teammitglieder deutlich wird. Die von Dr. Ferrari geleitete Gruppe zielt darauf ab, Benetzungsprozesse, Adsorption und Aggregation von amphiphilen Molekülen an der Flüssig-Fest-Grenzfläche, die Herstellung von stark flüssigkeitsabweisenden Beschichtungen und die Charakterisierung unter Verwendung von AFM- und 3D-Profilometrietechniken zu untersuchen. Die von Dr. Morán geleitete Gruppe konzentriert sich auf die Entwicklung kontrollierter Wirkstofffreisetzungssysteme und deren in-vitro-Charakterisierung unter 2D- (Bulkkörper und Substrat) und 3D-Bedingungen.
Der S neox 3D-Profilometer wurde aufgrund seiner Fähigkeit, große Oberflächen zu analysieren und wichtige Oberflächenparameter aus den Scans zu gewinnen, verwendet. Die Oberflächencharakterisierung mit Hilfe der Profilometrie wurde gemäß der ISO 25178 Norm durchgeführt, die die Regeln für die dreidimensionale parametrische Bewertung von Oberflächentexturen bereitstellt.
Die gesamte Oberfläche der einzelnen Deckgläser, die Zellen unter den untersuchten Bedingungen enthielten, wurde im Konfokalmodus analysiert. Zellen in ausgewählten Bereichen wurden ausgewählt, und die entsprechenden Profile in Bezug auf Höhe (H) und Länge (L) wurden mit der SensoSCAN S neox Software analysiert. Der entsprechende Formfaktor (SP) wurde als Funktion der H/L-Werte bestimmt.
Die Vorteile der optischen Scan-Profilometrie im Vergleich zur Rasterkraftmikroskopie (AFM) sind vielfältig: nicht-invasive und nicht-destruktive Charakterisierung sowie die Möglichkeit, größere Oberflächen zu analysieren, die nicht auf wenige cm2 beschränkt sind. Darüber hinaus sind die Messzeiten im Vergleich zur AFM-Technik reduziert, was die optische Profilometrie zu einer mikroskopischen Technik macht, die qualitativ und quantitativ hochauflösende Informationen im Nano-Mikrometer-Bereich bietet. Obwohl für diese Technik keine fluoreszierenden Proteinmarker oder optisch aktive Farbstoffe erforderlich sind, kann die 3D-Scan-Profilometrie im Konfokal- und Interferometriemodus eine hohe Genauigkeit bei der Bewertung der Zellgeometrieparameter bieten (Abb. 1a). Folglich zeigen 3T3-Fibroblasten unter Standardbedingungen eine typische bipolare oder multipolare Struktur mit länglichen Formen. Epithelähnliche Zellen wie HaCaT, HeLa und A431-Zellen haben polygonale Formen mit regelmäßigeren Abmessungen und wachsen in diskreten Patches. Aufgrund der Behandlung mit Nanopartikeln zeigen 3T3-Fibroblasten ein ovales Aussehen ohne Filopodien. Epithelzellen weisen einen massiven Mangel an Grenzen zwischen den Zellen und eine unregelmäßige Form auf.
Die Analyse der erhaltenen Profile (Abb. 1b) hat es ermöglicht, aus quantitativer Sicht verschiedene strukturelle Parameter wie Höhe und Länge von Kontrollzellen und solchen, die Behandlungen zur Induktion von Zellproliferation und zytotoxischen Effekten unterzogen wurden, zu bewerten.

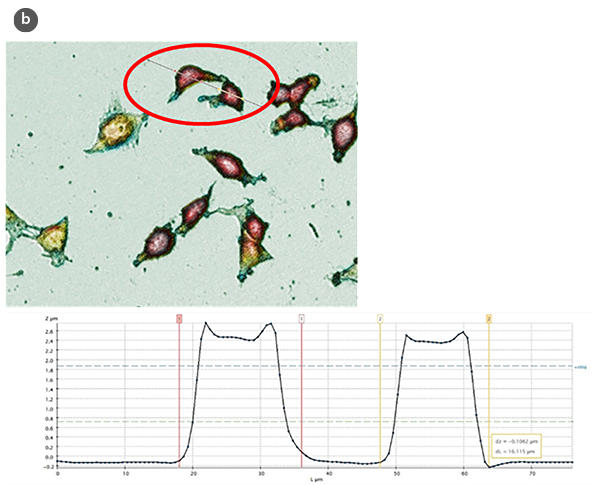
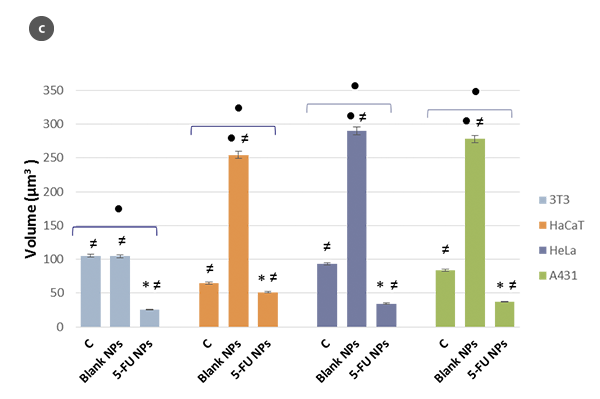
Die Veränderungen in der Morphologie der Zellen und ihr Formfaktor in Abhängigkeit der H/L-Verhältniswerte sind jeweils in den Abbildungen 2a und 2b zusammengefasst. Unter Verwendung eines Modells der sphärischen Kappe als geometrische Annäherung an die Zelle [5] wurden die Zellvolumina geschätzt (Abb. 2c). Die erhaltenen Werte stimmen mit denen überein, die direkt mit der SensoSCAN S neox Software erzielt wurden, wobei die Zellränder berücksichtigt wurden (Unterschiede in allen Fällen unter 5%).
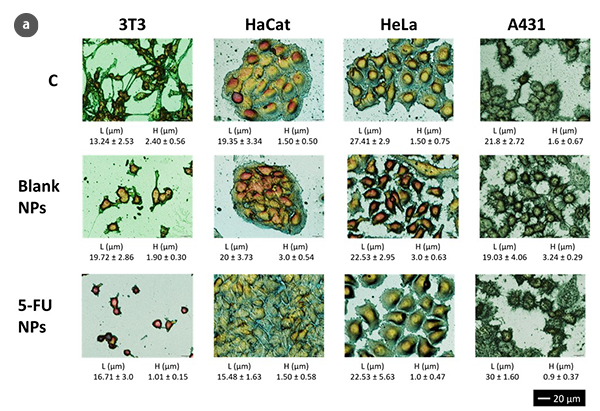
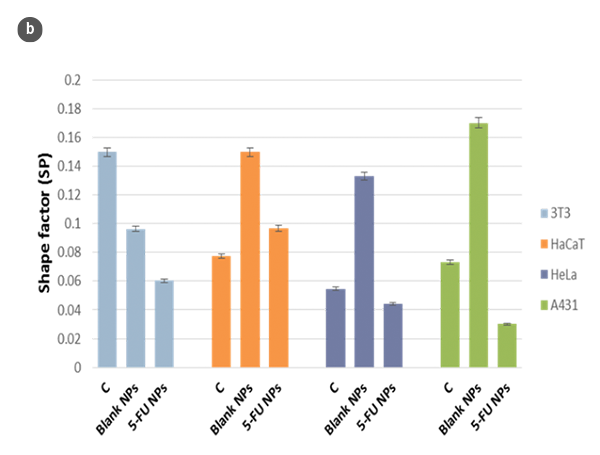
Unter Verwendung der optischen Profilometrie wurden Analysen der Zellmorphologie mit Reaktionszeiten durchgeführt, die mit konventionellen Methoden wie dem MTT-Zellviabilitätstest kompatibel sind [6]. Diese Analysen vermeiden jedoch einige widersprüchliche Ergebnisse aufgrund von Veränderungen in der Stoffwechselaktivität, die durch die Wirkung von MTT auftreten können, ohne dass sich die Anzahl der lebensfähigen Zellen ändert. Darüber hinaus beruht die Messung der Zellviabilität auf dem arithmetischen Mittelwert der Stoffwechselaktivität von 104-105 Zellen/ml. Diese große Anzahl von Zellen kann die Bestimmung von morphologischen Veränderungen in sehr frühen Stadien oder kleinen Teilen der Zellpopulation erschweren.
Die Bestimmung des Volumens einzelner Zellen durch 3D-Profilometrie stellt einen Mehrwert dar, um Muster oder Mechanismen des Zelltods festzustellen, die sonst mit einem einfachen Zellviabilitätstest, selbst auf Oberflächen, die weit über die Grenzen anderer Techniken (cm2) hinausgehen, nicht erkennbar wären. Diese Technik kann als interessantes Werkzeug zur Beobachtung von Veränderungen in der Zellmorphologie während des Screenings potenzieller Medikamente und toxischer Materialien angesehen werden. Sie ermöglicht eine Unterscheidung zwischen den beiden größten Modellen des Zelltods, insbesondere in sehr kurzen Behandlungszeiten zur frühzeitigen Vorhersage der Erfolgserwartungen eines therapeutischen Wirkstoffs.
Der Erfolg der Forschung in der Biomedizin liegt in der Anwendung von Nanomaterialien zur Behandlung von Krankheiten und in der Entwicklung von Werkzeugen für deren Diagnose. In dieser Arbeit erfüllt die 3D-optische Profilometrie mit qualitativen und quantitativen Analysen die Anforderungen für ein Screening-Tool für potenzielle therapeutische oder toxische Arzneimittelabgabesysteme, die das Zellwachstum stimulieren oder den Zelltod induzieren. Diese Arbeit ist die erste Veröffentlichung des Forschungsteams, das beide Disziplinen (Behandlung und Diagnose) kombiniert.
Die Fringe-Projektionstechnologie von Sensofar analysiert effektiv funktionale Texturierung im Mikrometerbereich. Dadurch können wir schnelle und zerstörungsfreie Messungen durchführen, um sicherzustellen, dass die funktionale Texturierung ordnungsgemäß funktioniert.
Dank des S wide können wir eine ausgezeichnete Qualitätskontrolle bieten, indem wir mit SensoVIEW alle Details zur Geometrie in einem Bericht zusammenfassen. Der S wide überwindet auch einige typische Einschränkungen von Fringe-Projektionssystemen, da wir polierte Oberflächen messen können.
References
[1] M. C. Morán, F. Cirisano, M. Ferrari. 3D profilometry and cell viability studies for drug response screening. Mat. Sci. Eng. C. 115(2020) 111142
[2] E. Guzmán, L. Liggieri, E. Santini, M.Ferrari, F. Ravera, F. Mixed DPPCcholesterol Langmuir monolayers in presence of hydrophilic silica nanoparticles. Colloids Surf B. Biointerfaces. 105 (2013) 284-293.
[3] J.L. Rinn, C. Bondre, H.B. Gladstone, P.O. Brown, H.Y. Chang. Anatomic demarcation by positional variation in fibroblast gene expression programs. PLoS Genet. 2 (2006) e119.
[4] M.C. Morán, J. Carazo, M.A. Busquets.Dual responsive gelatin-based nanoparticles for enhanced 5-fluorouracil efficiency. Colloids and Surfaces B: Biointerfaces 172 (2018) 646-654.
[5] J.A. Hessler, A. Budor, K. Putchakayala, A. Mecke, D. Rieger, M.M B. Holl, B.G.Orr,A. Bielinska, J. Beals, J.J. Baker. Atomic force microscopy study of early morphological changes during apoptosis. Langmuir 21 (2005) 9280-9286.
[6] T. Mosmann. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods 65 (1983) 55-63.











