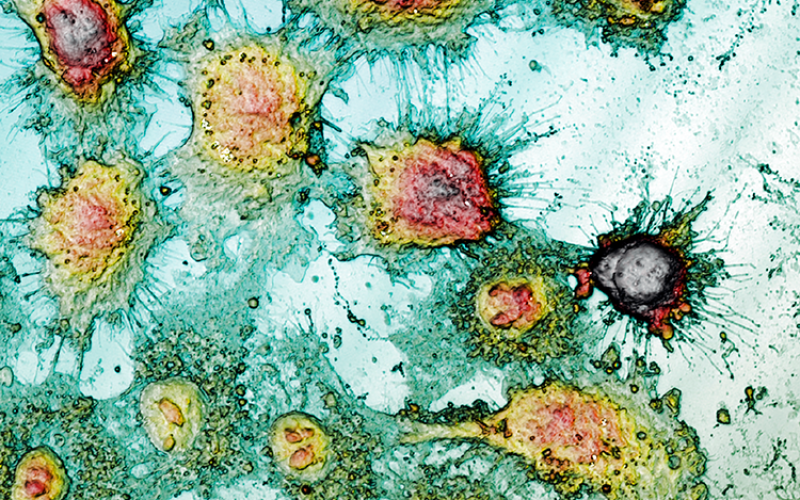
形态表面分析用于研究增殖性和毒性处理引起的细胞存活情况

Dr. Michele Ferrari, Dr. Francesca Cirisano, and Dr. M. Carmen Morán
这项工作是在巴塞罗那大学药学与食品科学学院(UB)与凝聚态化学与能源技术研究所(ICMATE-CNR)之间的合作协议框架下构想的(Codi GREC 18407)。本文是由Michele Ferrari博士和Francesca Cirisano博士(意大利热那亚ICMATE-CNR)以及M. Carmen Morán博士(西班牙巴塞罗那UB药学与食品科学学院)进行的研究的一部分。
利用形态测量学来确定细胞形态的变化,可以被视为筛选潜在药物和有毒物质的一种令人兴奋的工具,可以区分两种主要的细胞死亡模式。”
在细胞凋亡和坏死过程中,治疗的早期阶段会发生剧烈的细胞体积变化。从生物物理学和治疗学的角度来看,区分这些过程非常重要。细胞凋亡是一种程序性的细胞死亡过程,而坏死则是由于环境干扰而导致的意外死亡。当治疗引起细胞凋亡而非坏死时,往往会有更好的结果。此外,细胞增殖过程会导致细胞体积的变化,作为细胞生长的一个衡量标准。
在这项研究中,我们展示了非侵入性的形态表面分析技术与经过良好评估的生化方法相匹配,能够清晰区分生理细胞和病理细胞。简而言之,形态测量分析可以通过适当的纳米颗粒(NPs)诱导的细胞体积变化作为增殖和细胞死亡的前兆,与传统方法测量的细胞存活反应相兼容。
这个项目本质上是跨学科的,因为它需要对不同材料及其与感兴趣的生物实体的相互作用进行表征,正如团队成员具有不同背景所示。由Ferrari博士领导的小组旨在研究液体-固体界面上两亲分子的润湿过程、吸附和聚集,制备高度抗液体润湿的涂层,并利用AFM和3D形态测量技术进行表征。由Morán博士领导的小组专注于控制释放系统的开发以及其在2D(体积和底物)和3D条件下的体外表征。
使用S neox 3D轮廓仪是因为它具有分析大面积和从扫描中获取重要表面参数的能力。采用了ISO 25178标准对表面进行了形态测量的表征,该标准提供了对表面纹理进行三维参数评估的规则。
在Confocal模式下,对包含在研究条件下的细胞的个体盖玻片的整个表面进行了分析。选择了特定区域的细胞,并使用SensoSCAN S neox软件分析了高度(H)和长度(L)上的相应剖面。相应的形状因子(SP)是根据H/L值确定的。
光学扫描形貌测量技术相对于原子力显微镜(AFM)具有多重优势:非侵入性和非破坏性的表征,以及能够分析较大表面而不受限于几平方厘米。此外,与AFM技术的已有经验相比,测量时间也减少了[2, 3],使光学形貌测量成为一种在纳微尺度上提供更高分辨率的显微技术,提供更多定性和定量信息。尽管对于这种技术不需要荧光蛋白标记物或光学活性染料,但共焦和干涉模式下的三维扫描形貌测量可以在细胞几何参数评估方面提供高准确性(图1a)。因此,标准条件下的3T3纤维母细胞显示出典型的双极或多极结构,呈细长形状。此外,类似上皮细胞的HaCaT、HeLa和A431细胞呈多边形形状,尺寸更加规则,以离散斑块的形式生长。由于纳米粒子处理,3T3纤维母细胞呈椭圆形状,没有须突。上皮细胞之间边界丧失,形状不规则。
通过对得到的剖面进行分析(图1b),从定量的角度评估了几个结构参数,例如对照细胞的高度和长度,以及经过增殖和细胞毒性诱导处理的细胞。

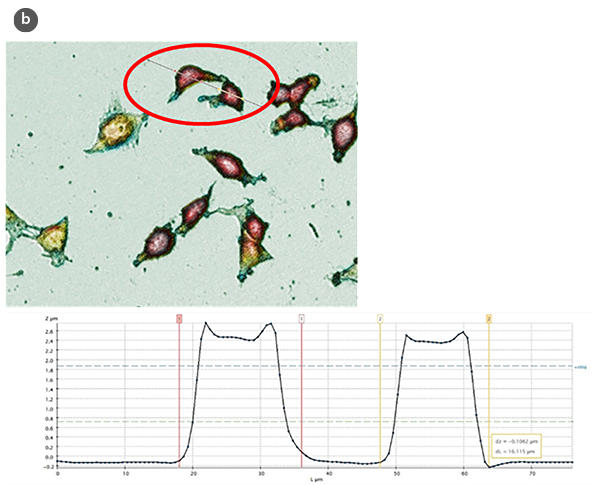
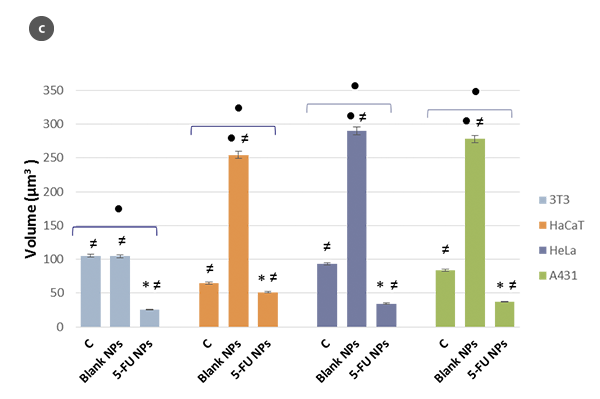
细胞形态及其形状因子在不同H/L比值下的变化总结如图2a和图2b所示。通过使用球冠模型作为细胞的几何近似[5],估算了细胞的体积(图2c)。所得数值与直接使用SensoSCAN S neox软件测量的细胞边缘考虑在内的数值相吻合(在所有情况下差异低于5%)。
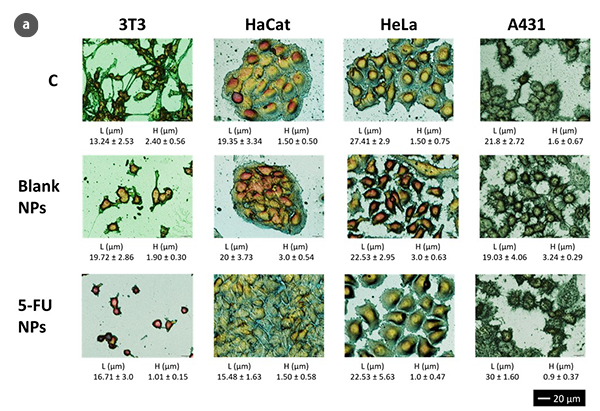
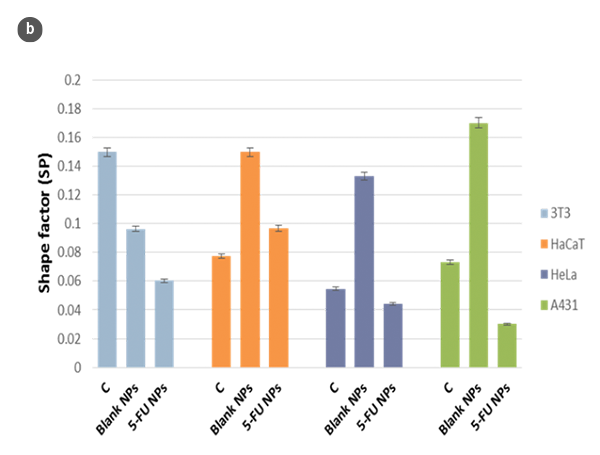
利用光学表面形貌测量,对细胞形态进行了分析,并且具有与MTT细胞存活检测等常规方法相兼容的响应时间[6]。然而,这些分析可以避免由于MTT作用而导致的代谢活性变化而不改变可存活细胞数量的一些矛盾结果。此外,细胞存活率的测量结果来自每毫升104-105个细胞的代谢活性的算术平均值。这么多的细胞数量可能会阻碍对细胞形态变化在非常早期阶段或细胞群体中的小部分的确定。
通过三维表面形貌测量确定单个细胞的体积是建立细胞死亡模式或机制的附加价值,这是其他技术(平方厘米级别)无法简单检测到的。这项技术可以被视为在筛选潜在药物和毒性材料时观察细胞形态变化的有趣工具,特别是在治疗过程中非常短的时间内,对细胞死亡的两种主要模式进行区分,以提前预测治疗药物的成功预期。
生物医学研究的成功在于将纳米材料应用于疾病治疗并开发用于诊断的工具。在这项工作中,3D光学表面形貌测量通过定性和定量分析,满足了作为潜在治疗或毒性药物传递系统筛选工具的要求,促进细胞生长或诱导细胞死亡。这项工作是研究团队首次结合这两个学科(治疗和诊断)进行的发表。
参考文献
[1] M. C. Morán, F. Cirisano, M. Ferrari. 3D profilometry and cell viability studies for drug response screening. Mat. Sci. Eng. C. 115(2020) 111142
[2] E. Guzmán, L. Liggieri, E. Santini, M.Ferrari, F. Ravera, F. Mixed DPPCcholesterol Langmuir monolayers in presence of hydrophilic silica nanoparticles. Colloids Surf B. Biointerfaces. 105 (2013) 284-293.
[3] J.L. Rinn, C. Bondre, H.B. Gladstone, P.O. Brown, H.Y. Chang. Anatomic demarcation by positional variation in fibroblast gene expression programs. PLoS Genet. 2 (2006) e119.
[4] M.C. Morán, J. Carazo, M.A. Busquets.Dual responsive gelatin-based nanoparticles for enhanced 5-fluorouracil efficiency. Colloids and Surfaces B: Biointerfaces 172 (2018) 646-654.
[5] J.A. Hessler, A. Budor, K. Putchakayala, A. Mecke, D. Rieger, M.M B. Holl, B.G.Orr,A. Bielinska, J. Beals, J.J. Baker. Atomic force microscopy study of early morphological changes during apoptosis. Langmuir 21 (2005) 9280-9286.
[6] T. Mosmann. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods 65 (1983) 55-63.












